
《自然·神经科学》: 贝勒医学院团队发现tau蛋白磷酸化和聚集的新机制!
*仅供医学专业人士阅读参考


tau蛋白过度磷酸化导致的神经纤维缠结是包括阿尔茨海默病在内的多种tau蛋白病的标志性病理特征。通常情况下,tau蛋白的磷酸化主要发生在丝氨酸和苏氨酸残基上,但近年来的研究显示,tau蛋白的磷酸化也可发生在酪氨酸残基上。
2023年,美国贝勒医学院Huda Yahya Zoghbi 团队就在《神经元》上发文,他们通过跨物种遗传筛选,发现酪氨酸激酶2(TYK2)可能是一个调节tau蛋白水平的重要因子,但至于TYK2是如何调节tau蛋白水平的,还不清楚。
近期,Huda Yahya Zoghbi 团队再次发文,进一步验证了,TYK2之所以是一个调节tau蛋白水平的重要因子,是因为TYK2可通过磷酸化tau蛋白的酪氨酸残基(Tyr29),来影响tau蛋白的稳定和聚集。
具体来说,这种磷酸化增加了tau蛋白的稳定性,使其无法通过自噬途径降解,进而促进了tau蛋白病理性聚集。而在tau病理小鼠模型中,研究人员发现,敲低Tyk2可以降低小鼠大脑中总tau和致病性tau蛋白的水平,减轻了由tau蛋白聚集引起的神经炎症。
研究发表在《自然·神经科学》上[1]。

论文首页截图
通过在人类神经母细胞瘤细胞系和小鼠大脑中减少Tyk2的表达,研究人员观察到,随着Tyk2表达的减少,tau蛋白的浓度也随之降低。这也意味着,TYK2确实能够调节tau蛋白水平。
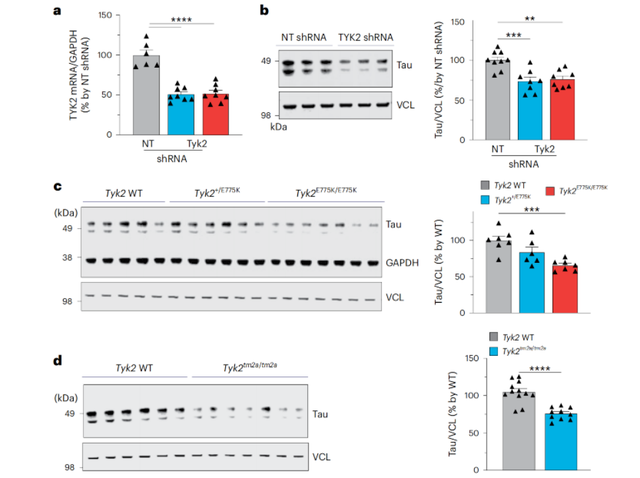
TYK2调节tau蛋白水平
进一步的免疫共沉实验结果显示,TYK2与tau蛋白存在相互作用。鉴于TYK2是一种酪氨酸激酶,可以在底物蛋白上磷酸化酪氨酸残基,因此,研究人员猜想,TYK2与tau蛋白结合位点可能在酪氨酸残基上,并以此来实现对tau蛋白的磷酸化。
为了验证这一猜想,研究人员进行了体外细胞激酶实验和免疫印迹分析。结果也证实,在TYK2存在的情况下,tau蛋白的酪氨酸残基确实被磷酸化了。
根据既往研究,tau蛋白共有5个可以被磷酸化的酪氨酸残基,分别是Tyr18、Tyr29、Tyr197、Tyr310和Tyr394。为了找到究竟哪个残基被TYK2特异性磷酸化了,研究人员分别用苯丙氨酸取代了tau蛋白的每个酪氨酸残基,然后再进行体外激酶实验,检测TYK2的磷酸化作用。
结果发现,只有Tyr29残基被苯丙氨酸取代的时候,TYK2介导的磷酸化才会消失。这也意味着Tyr29是TYK2磷酸化tau蛋白的关键位点。
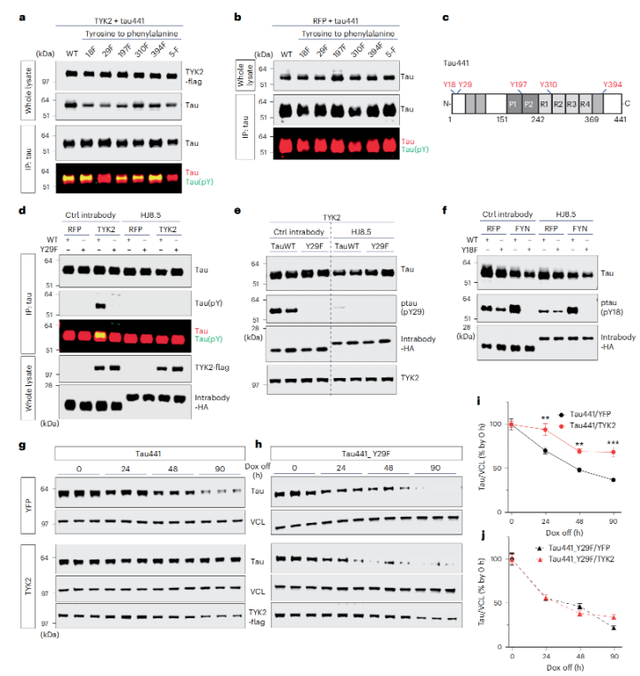
TYK2与tau蛋白结合,并特异性磷酸化了tau蛋白的Tyr29
接下来,研究人员探讨了TYK2介导的tau磷酸化在tau病理中的作用。结果发现,TYK2介导的磷酸化增加了tau蛋白的稳定性,并使其无法通过自噬途径降解,进而促进了tau蛋白病理性聚集(具体表现为在TYK2存在的情况下,tau蛋白的周转率,也就是tau蛋白在细胞内被降解的速度变慢了,而敲低Tyk2能够改善这一现象,尤其是在Tyr29被苯丙氨酸取代后,TYK2介导的磷酸化完全消失)。
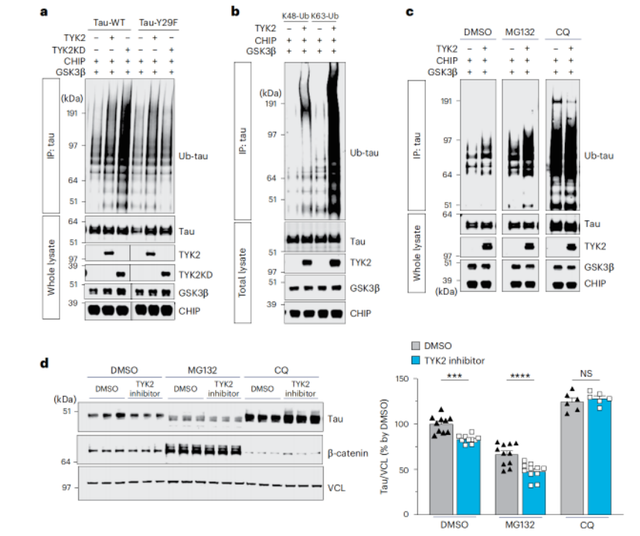
TYK2介导的磷酸化阻碍了tau蛋白通过自噬途径降解
进一步,研究人员还在tau病理小鼠模型中探讨了TYK2的作用。通过构建含有TYK2激酶域(TYK2KD)的P301S tau小鼠,研究人员再次证实,这种激酶可以通过磷酸化tau蛋白的Tyr29,引发小鼠脑内病理性tau蛋白的大量积累(而当Tyr29被苯丙氨酸取代后,这一现象就会消失)。
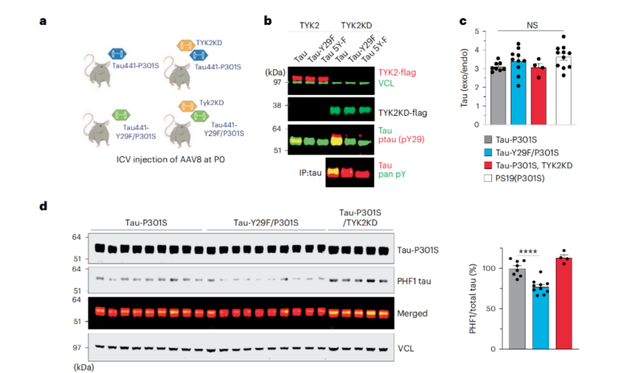
TYK2介导的磷酸化引发小鼠脑内病理性tau蛋白的大量积累
相反,当研究人员构建Tyk2敲低的PS19 tau小鼠模型后发现,敲低Tyk2可以降低小鼠大脑中总tau和致病性tau蛋白的水平,减轻了由tau蛋白聚集引起的神经炎症(如小胶质细胞增生减少)。
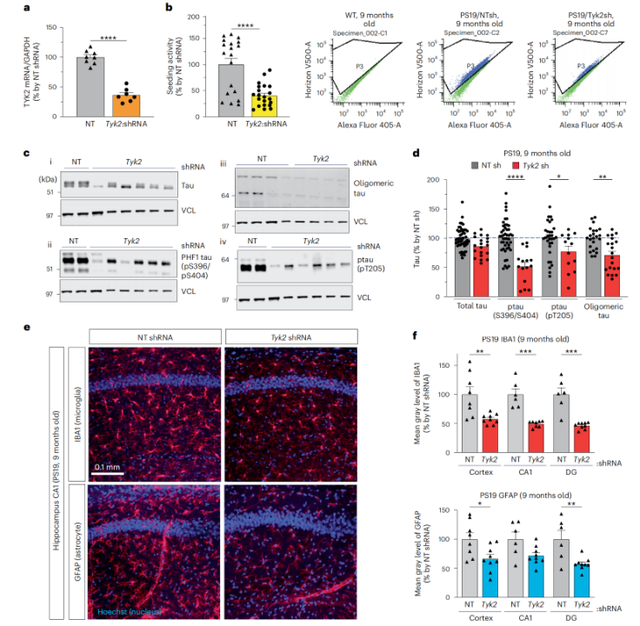
敲低Tyk2后,总tau和致病性tau蛋白的水平下降
综上,该研究首次证实,TYK2可通过磷酸化tau蛋白的Tyr29残基,来影响tau蛋白的稳定和聚集。这一发现不仅揭示了tau蛋白异常聚集的新机制,也为tau蛋白病的治疗提供了新的靶点。
由于完全缺失Tyk2可能会引发免疫缺陷,而文中也证实敲低Tyk2即可降低致病性tau蛋白的水平,因此,作者认为,部分抑制TYK2或许是一种有前景的治疗策略。
下一篇:没有了